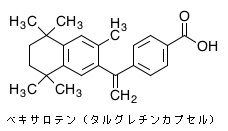
ベキサロテン(Bexarotene)は皮膚T細胞性リンパ腫(CTCL)の治療に用いられる化学療法剤の一つである。第三世代のレチノイドに分類される。商品名タルグレチン。アメリカのFDAに1999年に、欧州医薬品庁(EMA)に2001年に、日本のPMDAに2016年に承認された。
効能・効果
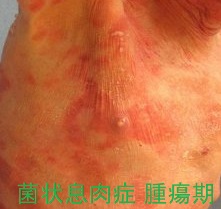
ベキサロテンは1つ以上の全身治療(経口薬)後に再発した、または治療抵抗性の、または他の局所治療に忍容でなかった患者のT細胞リンパ腫の皮膚症状の治療に使用される。未治療の皮膚T細胞性リンパ腫に対する有効性および安全性は確立していない。
適応外治療として非小細胞肺癌や乳癌.の治療に使われる事もある。
禁忌
ベキサロテンはレチノイドであり催奇性を持つ。
- 妊婦または妊娠している可能性のある婦人
- 重度の肝障害のある患者
- 製剤成分に対し過敏症の既往歴のある患者
- ビタミンA製剤を投与中の患者
- ビタミンA過剰症の患者
には禁忌である。
英国の添付文書では他に
について禁忌とされている。
副作用
添付文書で重大な副作用とされているものは、
- 高トリグリセリド血症(75.0%)、高コレステロール血症(81.3%)、膵炎、下垂体性甲状腺機能低下症(93.8%)、低血糖、
- 白血球減少症(31.3%)、好中球減少症(31.3%)、貧血(18.8%)、
- 肝不全、肝機能障害(AST(GOT)、ALT(GPT)、総ビリルビン等の上昇)(25.0%)、重篤な感染症(肺炎、敗血症等)、
- 間質性肺疾患、血栓塞栓症(肺塞栓症、心筋梗塞、脳血管発作等)、横紋筋融解症
である。発現率の記載のないものは頻度不明
そのほか、10%以上に血小板数増加、悪心、嘔吐、頭痛、倦怠感が発現する。
甲状腺への影響は、レチノイドX受容体を介した甲状腺刺激ホルモン減少作用によると思われる.。
相互作用
ベキサロテンの血中濃度はCYP3A4阻害効果を持つ薬剤(ケトコナゾール等)の併用で上昇する。CYP3A4誘導作用もあるので、CYP3A4の基質であるシクロホスファミド等の血中濃度が低下する。グレープフルーツジュースの摂取でもベキサロテンの血中濃度は上昇し、治療に影響すると思われる。
作用機序
ベキサロテンはレチノイン酸受容体(RAR)に対立する機能を持つレチノイドX受容体(RXR)への選択性を持つレチノイドである。(レチノイン酸はビタミンAが酸化されカルボン酸となったものである。)ベキサロテンは細胞周期を停止させ、分化やアポトーシスを誘導し、薬剤耐性の形成を防止するまた抗血管新生作用を有すると共に癌の転移を阻害する。RXRがアポトーシスを促進する一方で、RARは細胞の増殖を促進する。
物性
ベキサロテンは固形の白色粉末である。N,N-ジメチルホムアミドに溶け易く、メタノールまたはエタノール(95%)に溶け難く、アセトニリルに極めて溶け難く、水にほとんど溶けない 。
開発の経緯
スタンフォード研究所とラホーヤ癌研究財団(La Jolla Cancer Research Foundation、現在はサンフォード・バーナム医学研究所)の共同研究で発見された。
医薬品としての開発は1994年から米国Ligand Pharmaceuticals社により開始され、米国のFDAに1999年12月に「少なくとも1つ以上の全身療法に対して治療抵抗性を示した皮膚T細胞性リンパ腫」について承認された。
欧州ではEMAに2001年3月に「少なくとも1つ以上の全身療法に対して治療抵抗性を示した進行期皮膚T細胞性リンパ腫」について承認された。
日本ではPMDAに2016年1月に「皮膚T細胞性リンパ腫」を効能・効果として承認された。日本国内での第I/II相試験の症例数が少なく、脂質異常症、膵炎、内分泌障害(下垂体性甲状腺機能低下症、低血糖)等の特徴的で重篤な副作用が出現する事から、承認同日に『使用に当っての留意事項』が厚生労働省から発表された。
早期前臨床研究で、ベキサロテンがアミロイドを減少させて認知症症状を改善することがマウスのアルツハイマー型認知症モデルで示されたが、その後の実験では結果は一致していない。
出典